提高铺板后单细胞的存活生长率
较之单细胞分离的步骤,克隆效率(克隆的生长)在细胞株开发工作流程中常常被忽略。实际上,单个细胞的活力复苏和成功生长是一个众所周知的挑战性问题。

请点击文末“阅读原文”。
导语
针对单细胞克隆工作的新的基因编辑技术,新的细胞系、添加剂和自动化技术层出不穷,正在快速提高着细胞株开发的效率。然而,仍有许多因素会影响单个细胞的分裂潜能:在最初分离成单个细胞后,能否持续分裂和顺利生长成一个克隆细胞株。
确定单细胞生长的最佳条件像是在做一个拼图游戏,一块块影响因素的“拼图”包括:铺板前如宿主细胞系,转染的条件、方法,载体,细胞的筛选和复苏,甚至许多铺板后的因素,如板子的类型、板子的涂层、培养基的类型、培养基的体积等。
为了获得最佳克隆生长结果,不能只选择一个因素(如用何种铺板方法减少伤害细胞)进行优化,需要综合研究多个方面,将有害因素予以去除并对有益因素进行加强。
这些优化工作会让更多的单细胞在分离后存活下来,从而减少筛选所需的板子数量,最终减少后续处理克隆的时间和人工。
在众多因素中,有四个因素是本篇应用报告取得高克隆效率的关键:单细胞铺板的方法、基础培养基、培养基补充剂和细胞pool的内在差异性。
材料和方法
采用HD–BIOP3 (Horizon Discovery) GS敲除CHO K1商用细胞株进行所有实验。
有限稀释(LD)作为对照与VIPS™铺板进行比较(图1)。使用Gibco®CDCHO和CD FortiCHO™基础培养基,添加或不添加条件培养基、InstiGRO™(SAL Scientific) CHO和InstiGRO™ PLUS。
所有实验均使用Corning CELLBIND 孔板(3300)。在所有的实验中,加入200μl细胞培养基至每孔中,板子在37℃摄氏度孵育,用Cell Metric®全孔细胞成像仪监测第0、1、7和14天的单克隆源性和生长状况。所有的细胞群落(包括VIPS和对照LD)都需验证是否来源于单个细胞,因为在LD板上看到的许多细胞群落实际上来自2个或更多的细胞。
结果和讨论
铺板方法 – LD vs VIPS
LD一直被认为是单细胞分离方法中最温和的。然而,这个方法耗费人工且效率低下,其结果受不同操作人员的影响差异很大。另一个众所周知的实际问题是,尽管铺板得到的单细胞孔数基本符合泊松分布计算出的理论值,但实际工作中最后长起来的克隆更多的是从两个或多个细胞起始而来,而不是单个细胞,这个现象在全孔细胞影像仪上市后被更清晰地揭示出来。
这些挑战促使新一代的自动化铺板方法的出现,比如VIPS:通过基于图像的细胞检测,每孔中有一个细胞的机会比有限稀释法更高和更普遍。
在初始最适细胞浓度下,VIPS常规可以达到70–85%的铺板效率(单细胞孔比例);而LD只能达到30%(泊松分布计算,使用0.5个细胞/孔浓度)。实际上,许多LD的实验人员常使用更低浓度如0.2个细胞/孔,来获得预计中更大的分离出单细胞的几率,或用多轮LD来实现这个目标。
从图2可以看出,VIPS板产生了33个克隆孔(单个细胞孔),而LD 板只有12个。更重要的是,通过成像验证(用VIPS或Cell Metric)可知LD板上有11个细胞孔并不是克隆的(不是单个细胞起始而来,用红色叉表示),而在以前没有影像验证设备时这些都会被认为是单克隆的。

图1 – VIPSTM确保了较高的铺板效率。
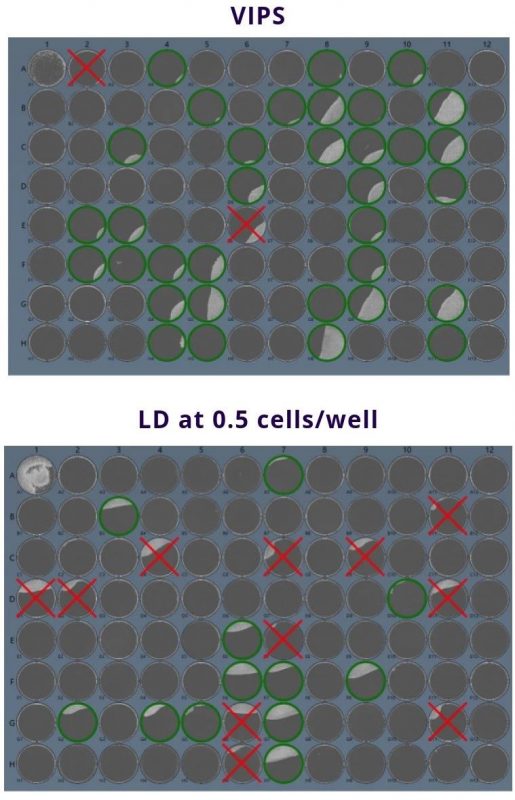
图2 –VIPS板和人工LD板的Cell Metric全览图。绿圈标明细胞群落起源于单个细胞的孔。红叉表示细胞群落来自多个细胞的孔。
补充剂 – 条件培养基vs InstiGRO CHO vs InstiGRO CHOPLUS
我们从经验和上面显示的数据中知道,有些培养基可能比其他培养基更“贫瘠”(没营养),往往并不适合单细胞克隆阶段。故而在此阶段用点“补品”(促生长补充剂)开始变得很关键,这能减轻细胞压力和帮助细胞生长成群落用以进行之后的评估。大多数的细胞株开发研究者不会去添加血清,多采用条件培养基来促进单细胞的分裂,但由于结果变异较大,常常需要多做一个额外的步骤来收获细胞和验证条件培养基的性能。
将VIPS结果与LD结果(相同的生长条件)比较,可以清楚地看到VIPS的克隆效率高很多,每个板上都有很多由单个细胞生长而来的克隆(图3上)。
基础培养基 – CD CHO vs FortiCHO
通常商品化的细胞株已提供有最适生长条件;然而,这些条件不一定对单细胞生长也是适合的。从CLD到生产的整个过程中尽量保持培养基条件的一致,也常常是细胞株开发小组的目标。然而,适合的基础培养基(base media)很可能会影响单个细胞生长的潜力,因此有必要予以研究。图3显示,在条件培养基存在下,FortiCHO基础培养基获得的克隆生长结果大于CD CHO基培养基。
加入InstiGRO后,不同基础培养基的克隆生长结果就没有看到差异。表明不同基础培养基对特定细胞的适生长性存在差异,添加足够的促生长补充剂则可消除差异产生的影响。
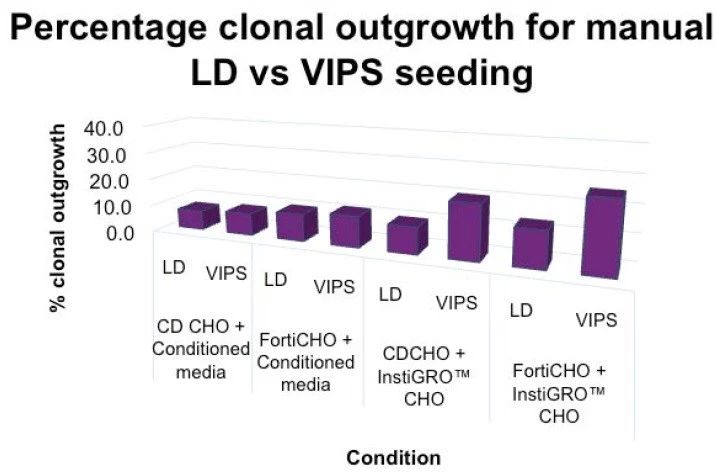
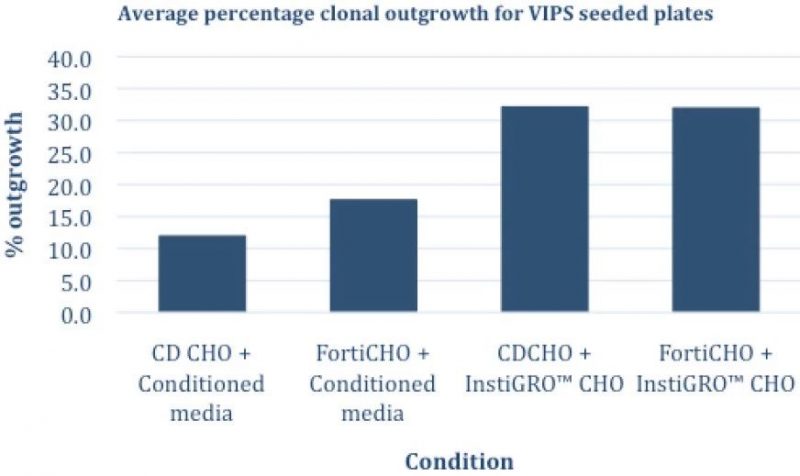
图3 – (上) 人工LD和VIPS铺板后,条件培养基和InstiGRO的克隆结果比较:VIPS铺板加InstiGRO,与人工有限稀释相比,每块板中克隆生长率提高了大约两倍。(下)VIPS铺板的平均克隆生长率。图中显示了加入条件培养基后CD CHO与FortiCHO的平均克隆生长结果比较;和加入 InstiGRO CHO 后,CD CHO 和FortiCHO的比较:与单独使用条件培养基(12–17%)相比,CHO可导致约32%的克隆生长,从而使每板的克隆数量增加了一倍。
对CD CHO和FortiCHO来说,在条件培养基中进一步添加补充剂后,克隆生长孔的数量都得到显著增加(见图4)。
InstiGRO CHOPLUS 是InstiGRO CHO的优化升级版产品,进一步提高了本实验中克隆生长的百分比(见图5)。
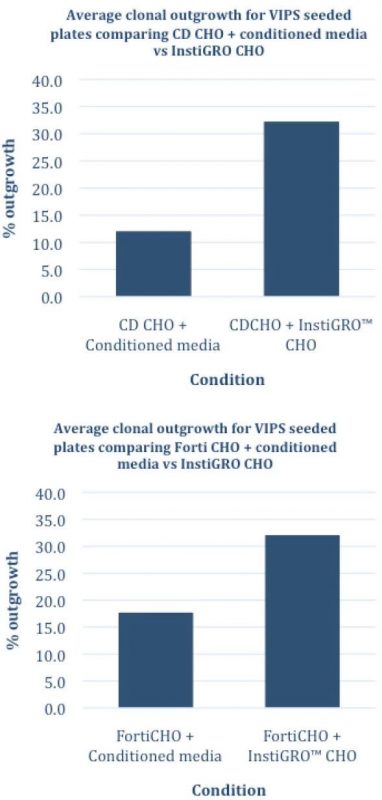
图4 –VIPS铺板后平均克隆生长率的比较:CD CHO(上)和Forti CHO(下)+条件培养基vs InstiGRO CHO补充剂。
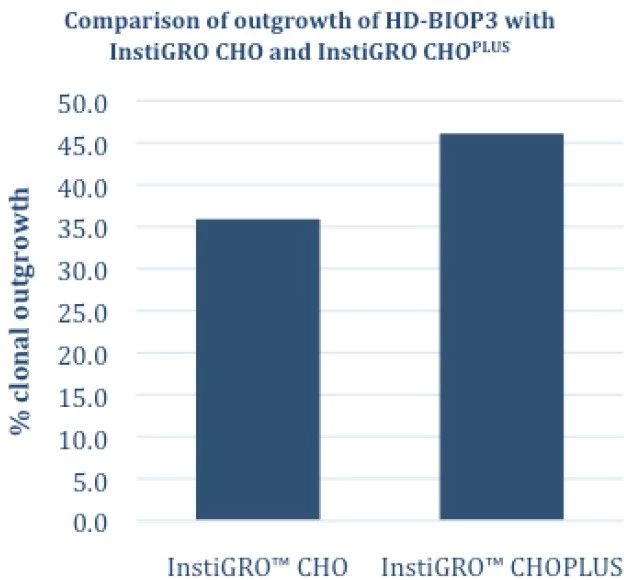
图5 –VIPS铺板,FortiCHO和条件培养基条件下,HD–BIOP3的生长结果比较:InstiGRO CHO vs InstiGRO CHOPLUS,生长率进一步提高10%。
Pool 的不同表现
最后,在优化亲本细胞系并建立支持单个细胞生长的最佳条件之后,很重要的一点是要考虑转染和相应的筛选对生长的影响,因为相同的细胞培养条件的不同转染群体也可能会表现出内在的差异。图6说明了这一点,因此应该在一系列pool/已建立的细胞株上执行优化。
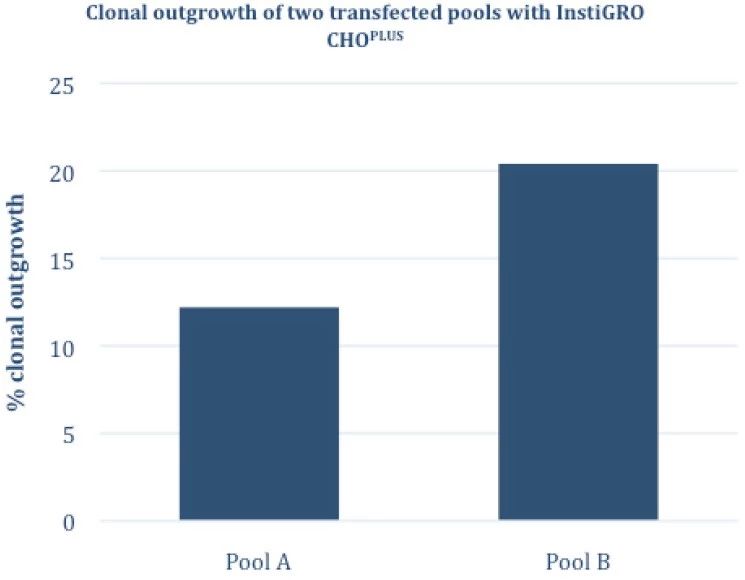
图6 –使用VIPS铺板,添加InstiGRO CHOPLUS,两个抗体表达pool的克隆生长情况。可以看到来自同一亲本细胞株表达相同抗体分子的细胞pool间也会存在差异,也可以看出分子表达对克隆生长的影响,显示出优化条件去获得尽可能高的克隆生长结果的重要性。
结论
数据显示,在优化生长条件时,需要考虑众多影响单细胞生长的因素。合适的铺板方法和设备可以从一开始就显著提高铺板效率,但如果单细胞所处的培养条件和环境不适合,那后续的生长和克隆效率仍然会一直与困难相伴。在本实验中,VIPS和InstiGRO CHO产品的组合显著且持续地增加了克隆生长的百分率。在未来的工作中,我们将把这些研究扩展到来自不同供应商的不同商品化细胞系。
