蛋白药物是一个数十亿美元的市场,但获得最适的生物治疗生产细胞株一直是工艺中的主要瓶颈。“你能以多快的速度让分子进入一个稳健高效的细胞克隆?对于创新药,进入临床的时间意味着一切” ,纽约州立理工学院纳米生物科学教授Susan Sharfstein解释道。
在过去的几十年里,CHO细胞一直是这些生物药生产的首选表达系统。根据Sharfstein的观点,“这里面有一些历史因素,因为FDA对CHO系统很满意,导致采用这个系统会让监管批准更容易。” 并且这类细胞也很容易处理,能悬浮培养,对病毒感染也有一定的抵抗力。此外,CHO细胞与其他啮齿类动物细胞系相比,还具有与人更相似的糖基化形式。但可能最重要的是:CHO可以在数克每升的效价水平上表达一系列蛋白质,包括酶和抗体。
不幸的是,得到高产细胞株的过程十分低效和繁琐,常常需要在数周内筛选数千个克隆。因为在细胞中引入多个开放阅读框(ORF ,openreading frame)的结构常常会导致破碎的或重排的DNA片段整合到了基因组中,而不是所需要的序列,故而预筛选的步骤不可或缺。
Solentim的首席商务官Ian Taylor表示,目前的一些努力正在简化这些过程,并能显著缩短细胞系开发的时间。2019年,Solentim与ATUM宣布合作快速开发稳产细胞株。ATUM宣称其Leap–In Transposase®表达技术的整合效率“比传统细胞高几个数量级”。Taylor解释说,通过转座酶将GOI(Gene of interest)传递到细胞中,不是随机整合,而是靶向于特定位点。并且,质粒的结构完整性,基因与筛选标记的连锁,以及表达比例平衡都能够得到保持。此外,外源基因插入在染色质的开放区域,这些区域转录活性也更强。“主要的好处是,这让转染后的克隆分布显著偏向于高产细胞株,每个项目需要筛选的克隆数量更少,也不需要荧光标记。现在只需筛选200个或更少的克隆中就可以完成一个项目。”
研究员还可以添加无动物成分的促生长添加剂,如Solentim公司的InstiGRO,来帮助单克隆细胞恢复活力,并生长成细胞群落。(更多相关内容连接请参考文末链接)
提高CHOs的表达能力
Sharfstein的实验室多年来一直在研究CHO细胞的生产力,她说很多因素都可能影响产量,包括培养条件的细节,以及所表达蛋白分子的特性。Sharfstein说:“我们几年前做了一个很好的研究,用UCB Celltech检测了两种单抗的生产能力。两种单抗只有一个氨基酸的差异,但产量却相差超过10倍。”
另一种提高蛋白表达的可能策略是改进目前的筛选系统。
目前代谢筛选几乎取代了抗生素,用细胞生存所需的酶分类,当前主要有抑制谷氨酰胺合成酶(GS)或二氢叶酸还原酶(DHFR)的两类筛选系统。其中GS系统更为常用,在这种情况下,只有携带外源基因(GOI连接有GS基因)的细胞才能存活,一些公司现在可以提供GS完全敲除的细胞株(GS–null CHO K1),消除了抑制GS的有毒化学物质的需要。
这类技术的发展部分得益于本世纪初CHO基因组测序和基因编辑技术的进步。“我认为CRISPR和相关技术未来可以编辑各种细胞株,这将是巨大的进步”。目前,她正在与HocusLocus公司合作研究一种新的细胞系筛选方法,该策略基于在GOI的3 ‘非翻译区表达一种siRNA。mRNA转染细胞作为筛选标记物,然后可以被siRNA降解。她说,这比抗生素或缺陷互补的筛选方法要快得多。(GOI/siRNA高表达筛选系统介绍可参考:http://hocuslocus.com/applications/)
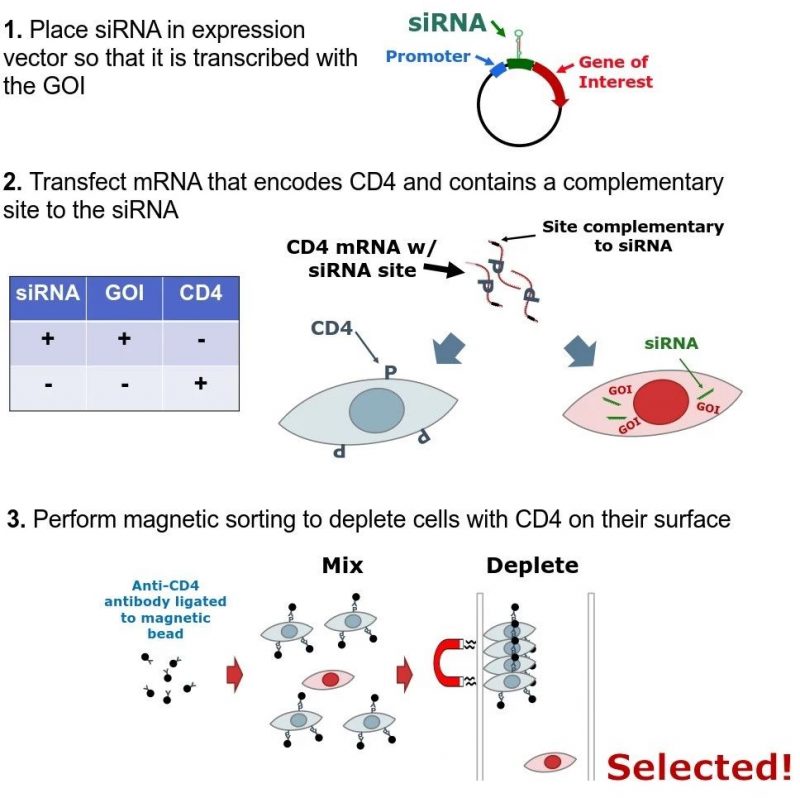
图示:先转染携带目的基因和siRNA的载体,几天后再转染mRNA;mRNA用于表达CD4,也可以被siRNA 靶向降解。高表达目的基因的细胞克隆,也必然会高水平生成siRNA,也就会高效降解CD4的mRNA,降低CD4的表达,这样就无法或难于用磁珠交联的抗CD4抗体扣除;反之,低水平或不表达目的基因的克隆,siRNA水平低,CD4高表达,就易于被磁珠扣除;这是一个多轮富集高表达目的基因克隆的新技术方法。
编辑不仅能带来更有效的筛选方法。据Sharfstein说,她和一些人正致力于细胞株开发和工艺工程,来生产肝素和肝素硫酸盐,这些都是碳水化合物了,甚至都不是蛋白。“工艺过程常常没有模板,你需要进行不少代谢工程的研究来优化生产途径。
CRISPR:一个应该谨慎使用的强大工具
像Sharfstein一样,Charles River实验室的生物学主任Anne–Marie Zuurmond认为很明显CRISPR正在革新细胞株的开发。 “这个系统的美妙之处在于,RNA分子驱动着系统的特异性,而这些分子易于设计和生产。CRISPR领域仍处于起步阶段,但正在迅速发展”,她说,针对mRNA来改变细胞的特性是一种强大的工具,因为宿主基因组并没受到影响。
在CRISPR前沿,最近的焦点是发现新的核酸酶。Zuurmond说:“有不同的性质和针对不同需求的新的Cas9–like蛋白不断涌现,它们扩展了CRISPR工具箱,为基因组编辑和基因调控提供了无限可能。”分离自古菌的Cas14就是这样一个例子,比Cas9小,还可以切割单链DNA(ssDNA)。据报道,另一种Cas9变异体只需要最少的PAM(原间隔序列临近基序),这意味着基因组的更多部分可以作为靶点(该文献介绍见下图)。

图示:CRISPR/Cas系统原本是原核生物为了应付外源遗传物质入侵的一种防卫机制,所谓的CRISPR序列,就是敌人的“黑名单”。每当有一个新的敌人入侵,CRISPR/Cas系统就会剪下它的一段基因作为“身份证”,插入CRISPR序列中保存起来,以备下一次敌袭。
但这段剪下来的“身份证”不是随意选择的,它们的附近往往具有一段特殊的序列,叫做原间隔序列临近基序(PAM)。这段序列根据Cas酶的种类不同而有所不同,现在科学家最常使用、最成熟的spCas9,主要识别的就是NGG序列(N指任意碱基)。spCas9也是目前PAM适用最广泛的Cas酶。但我们简单计算一下,DNA存在四种碱基,NGG出现的可能性只有十六分之一。
博德研究所(Broad Insititude)的David Liu带来了全新的进化版Cas酶——xCas9,比起目前使用最广泛的spCas9,xCas9可以实现更广泛PAM,同时脱靶效应还大大降低。
不过,新技术也有一些必须承认的缺点,包括潜在的脱靶效应。Zuurmond说,CRISPR还需要外源性介质来启动修改基因组的过程。她解释说,Charles River使用CRISPR作为其他策略的正交方法(orthogonal approach)。“对于蛋白过表达细胞株的开发,质粒、慢病毒和CRISPR都得到了应用,涵盖了随机或靶向整合,转染基因的瞬时和稳定过表达的各种方法。”许多公司也采用了类似的方法,主要用更老的一些基因编辑技术,比如rAAV(重组腺相关病毒),用CRISPR做概念验证(proof of concept),甚至将两种方法混合使用。
Zummond说:“其他基因组编辑技术和干扰方法都有其价值所在,在某些情况下,它们可能会比CRISPR更合适。CRISPR应该被认为是一项非常有价值的技术,可以增强我们的细胞株工程的能力,但它不是唯一的选择。”
单克隆性的确证
Taylor说,对于细胞株开发,无论是为了生物治疗蛋白的生产、基因治疗还是药物的发现,研究人员都必须分离出单个细胞并提供单克隆源性的证据。这一问题近年来受到了FDA的广泛关注,他警告说,如果细胞不是克隆的,其中一个细胞株就可能具有生长优势,超过另一些细胞株。“这会导致产品产量下降,甚至生产出错误的产品—这会是一个代价高昂的错误。”
Solentim提供VIPS(Verified In–situ Plate Seeding)等设备,在日常工作中方便地提供确证单克隆源性的记录。VIPS可以将单个细胞铺入96孔板的干孔中,并进行成像以满足单克隆源性要求。同样由Solentim公司开发的Cell Metric是一种成像仪,用于跟踪克隆生长为细胞群落,Taylor说这是FDA所要求的。
层出不穷的定点基因整合的新方法,新的克隆筛选方式,,CRISPR应用的新领域,以及新的自动化和更稳定的工作流程,让细胞株开发比以往任何时候都更有效率,必将会影响生物医学研究的几乎每一个领域,加快蛋白 (甚至是碳水化合物)的治疗药物的开发。

