导语
自上世纪90年代以来,单抗和疫苗等生物药迅猛发展,在全球市场以约每年10%的复合增长率持续增长,预计到2022年,生 物药将在百强制药企业的销售额中占据惊人的52%。
与传统的小分子药物不同,生物药是在具有相同基因组成的哺 乳动物细胞内生产。为保证产品质量和一致性,并满足监管 要求,杨森研发中心的细胞系开发小组必须证明其细胞系为单克隆细胞系,即来源于一个细胞。
杨森细胞系以往的开发流程
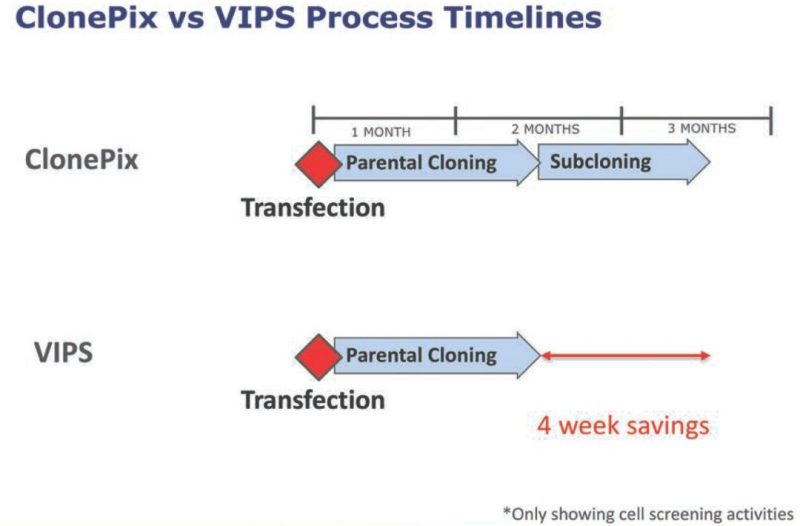
在之前的10年,ClonePix™ 技术是杨森细胞系开发的基石。该四人小组 需要5个月的时间去完成一个项目:先创建约有8,000万个CHO细胞的多个转染pool,然后将其中约800万个细胞人工转移到半固体培养基的培养板中,接着在ClonePix中筛选(用Alexa488 Protein-G)出最好的800到1,200个抗体分泌克隆。
这800到1,200个克隆经过几天的分裂后,转到96孔深孔板中继续增殖;检测抗体滴度,再从中筛选出最好的48个亲本克隆,转入摇瓶中继续扩增 ;分批补料式摇瓶中检测抗体滴度,从中筛选出最好的20个亲本克隆进行亚克隆;重复上述流程:ClonePix筛选,96孔深孔板,第二轮补料式摇瓶,直至筛选出24个细胞系到ambr®250系统上检验(见图1):

ClonePix 方法在克隆源性上存在的问题
Clonepix的筛选为什么要重复两次?
因为研究团队无法证明每个细胞群落都来自单个细胞。他们假定细胞是等间距的,但只有95%的把握确定两个细胞没有靠的很近或挑取时挑头没有触及相邻的细胞群落。
这种不确定性对团队来说是一个大问题,因为FDA要求制药公司出示主细胞库(MCB)具有克隆源性的证据。FDA认为这将有助于确保生物药物批次间的一致,减少药物意外副作用的可能。
为了克服这一问题,研究小组不得不重复ClonePix筛选,为的是在统计学上有更高的几率来保证每个产量最高的细胞群落中的细胞都是一样的。 然而,这却让他们的细胞筛选的时间几乎增加了一倍,达到两个半月。
采用新的Solentim技术平台 – Cell Metric CLD 和 VIPS系统
团队决定替换ClonePix。除了克隆源性的问题,之前他们还需要使用昂贵的荧光蛋白(Alexa488 Protein G)来识别分泌抗体的细胞,还依赖胎牛血清来培养细胞。
通过比较几种技术,他们先选择了Solentim的Cell Metrics CLD成像和分析系统。“Cell Metrics具有最好整孔成像效果和克隆源性报告”,杨森细胞系开发组的复责人Tom Kelly说,“通过对仪器的演示,我们对该系统的性能和极高的图像质量印象深刻”。Solentim也不断向团队通报即将面世的新技术平台,杨森之后很快又购买了VIPS系统。VIPS的原理是在多孔板的各微孔中重复分配30nl的液滴,直到检测到孔中又一个细胞。当一个液滴滴入后,系统即对液滴进行20倍Z轴成像,确认是否含有一个细胞。
在检测到液滴中的单个细胞后,培养基从另外的通道注入,随后利用VIPS进行整孔的D0成像。
“许多单细胞打印或移液系统可显示细胞在到达多孔板前的图像,而不是在多孔板中的图像 ”,Kelly 说。
“ 我们认为VIPS对多孔板本身的成像是非常重要和可靠的。” “如果你只是在细胞去多孔板的路上拍了张照片,那实际到板子中的细胞可能比你想象的要多”。
此外Kelly补充说,由于VIPS可分配纳升级的液滴,“滴入孔中央的培养物很少,不需要担心孔的边缘对图像的影响,可以很容易地定位细胞,并向监管部门提供更可靠的细胞系克 隆源性证明”。
VIPS方法的优势
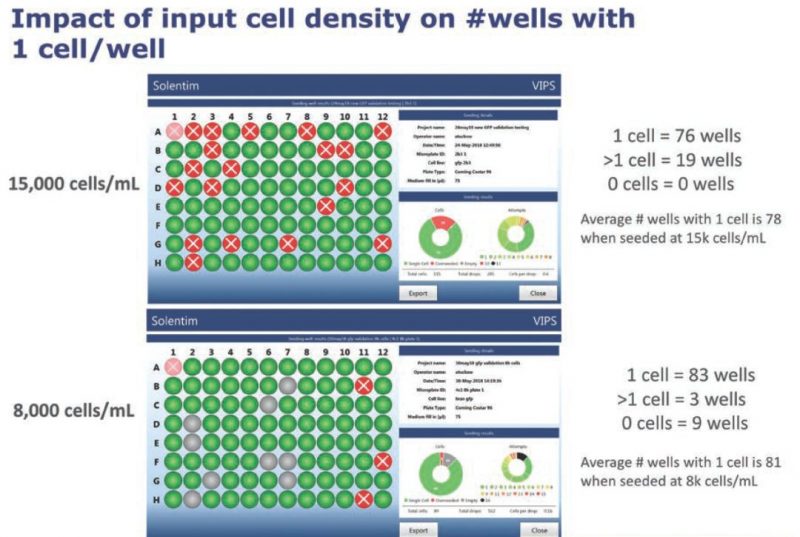
通过证明多孔板的特定孔中只有一个细胞,VIPS免除了再做亚克隆的必要,从而将每个项目时间缩短了四到六个星期。为了进一步验证VIPS的性能,杨森细胞系团队用不同浓度细胞稀释液(细胞池中从8,000到15,000 个细胞/毫升不等)开展研究,并使用现成的CD–CHO无血清培养基,结果如下:
VIPS方法的高铺板效率和验证:
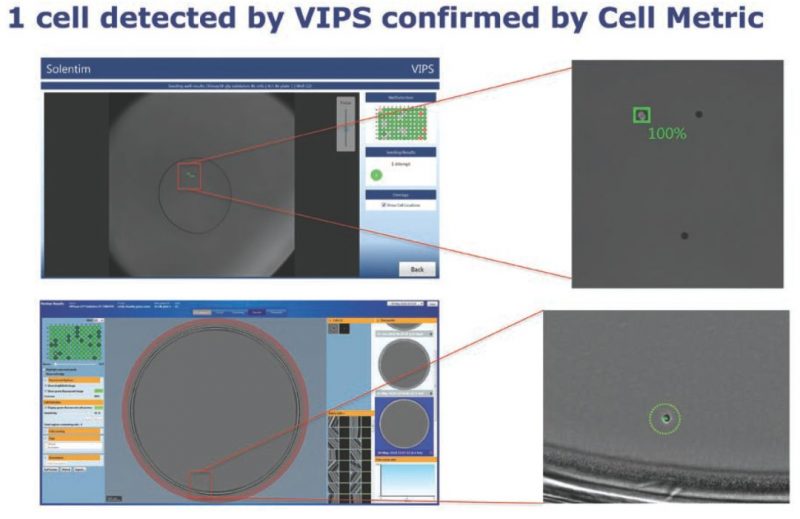
团队发现,即使在最低细胞浓度,VIPS的铺板效率也高达87%(图3)。VIPS能准确分辨出含有一个或多个细胞的液滴,随后通过Cell Metrics整孔成像验证,VIPS在95%的情况下可正确识别包含单个细胞的微孔(图4)。

幽灵细胞孔发生率低
VIPS显著降低了幽灵细胞孔(假阴性)的发生率,在4,750个微孔中,只有3个孔(0.06%)在Cell Metric 上显示有一个细胞但在VIPS没有检测到,并且这3个孔都发现了由于分液喷嘴堵塞而造成的液滴溅散(数据未显示)。相比之下,用常规的人工有限稀释法(LD)和成像,幽灵细胞孔发生率高达10%。
细胞存活率和预期的细胞生长率
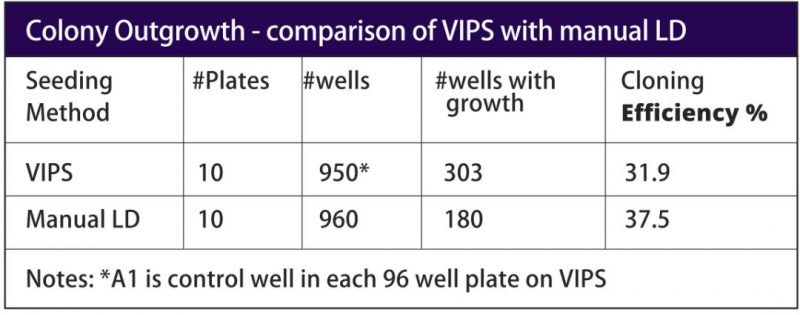
此前,该小组用排枪在96孔板中做有限稀释,他们只能平均在每块板的48个孔中转入单个细胞,其中只有约14个细胞(约29%的生长率)能生长为克隆。现在使用VIPS,他们能在每块板的大多数孔中接种并验证单个细胞。并且VIPS对细胞的操作非常温和,有类似人工LD的生长率和克隆效率(31.9%),但却可以将每块板的克隆数量增加一倍。Kelly说,”我们现在可以在更少的板中筛选更多的克隆,这太棒了,因为这能极大地减少筛选所需的多孔板数和工作量。“(见图5表)
VIPS产生的克隆与LD法相比,对蛋白表达的浓度也没有影响。
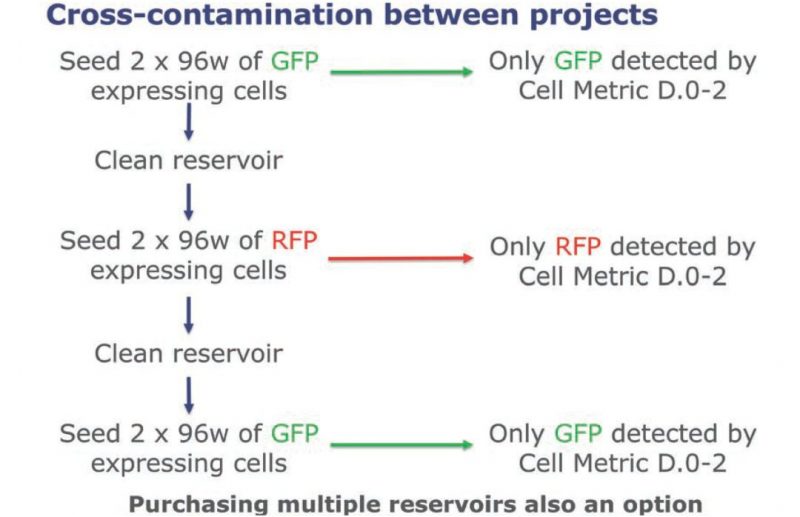
在VIPS上方便地切换不同细胞系开发项目并且避免交叉污染:
杨森的团队经常要同时针对多个分子建立细胞系,但这却容易增加交叉污染的风险。
通过对表达不同荧光蛋白的细胞切换铺板和成像(Day0–Day2),该小组测试了VIPS的自动清洗和消毒性能:将绿色荧光蛋白 (GFP)表达细胞铺板和成像,然后红色荧光蛋白(RFP),然后再次GFP的对照板,在不同荧光细胞切换之间清洗细胞池。VIPS的 结果显示没有交叉污染发生。(见图6)
实验流程一致化
Kelly 评论道:“事实上,VIPS可以控制在培养基中和铺板过程中的许多变量,一致的工作流程让我们现在每个全职人员的产出都差不多。”“ 此外,整个流程更省钱了,唯一额外的成本就是稀释培养基”。
未来展望:继续发展VIPS技术和改进细胞系开发的工作流程
杨森细胞系开发部门已经购买了第二套VIPS设备,以增强工作能力,并能轻松地在两套VIPS设备之间切换。他们打算用VIPS 图像作为其克隆报告的一部分,包括液滴图像和整孔的图像,来证明他们细胞系的克隆源性。Kelly解释说“: 我们设想将来只需向FDA提交整个孔中液滴的VIPS图像。”
该小组还优化了表达载体,让只有最高产量的克隆才能在转染筛选流程中存活,这样在单细胞克隆之前就不再需要做细胞富集。下一步,他们还计划利用VIPS可选的荧光模块来进一步改善他们的转染pool。
“目前我们做转染时,DNA会随机整合到细胞基因组的不同位点,”Kelly说。
该小组希望创建一种可以被重组酶识别的DNA“着陆点”,这样更多的细胞就可以在已知的位置进行转染,从而缩短所需的时间。“如果着陆点有荧光标记,我们就可以用VIPS来筛选掉那些没有成功重组的细胞。”
该团队目前每个项目用10块96孔板,未来还会在384孔板中铺板,这会进一步减少每个项目的用板数。未来客户在细胞系开发过程中再也不会消耗掉大量多孔板和使用自动移液工作站了。
